25bp
DNA ladder
● 產(chǎn)品編號及規(guī)格:
RTM444
50次 (250 μl)
● 產(chǎn)品組成:
|
貨號
|
名稱
|
規(guī)格
|
|
RTM444-01
|
25bp DNA ladder
|
50次(250 μl)
|
|
DL070-01
|
6×Native-PAGE DNA上樣緩沖液
|
1 ml
|
|
DL020-01
|
6×DualColor DNA
loading buffer (雙染料)
|
1 ml
|
● 產(chǎn)品簡介:
本產(chǎn)品是由8條帶狀雙鏈DNA條帶組成的精準定量Marker�����,適用于聚丙烯酰胺凝膠電泳中DNA條帶大小和含量的分析。8條帶的大小分別為25�,50,100����,150,200�,300,400����,500bp。其中200bp
bp條帶為加亮帶�,含量為100ng/5μl,其余條帶濃度為50ng/5μl����。
本產(chǎn)品為雙鏈DNA
Marker����,適用于非變性的PAGE電泳和瓊脂糖凝膠電泳���,不適用于尿素PAGE電泳��。由于片段較小�����,如使用瓊脂糖分離��,建議使用高分辨率瓊脂糖凝膠電泳分離����。
按照每次上樣5
μl計算�,該產(chǎn)品可以使用50次。
● 儲存�、效期及運輸:
-20℃ 貯存;有效期3年;濕冰運輸����。
● 使用方法:
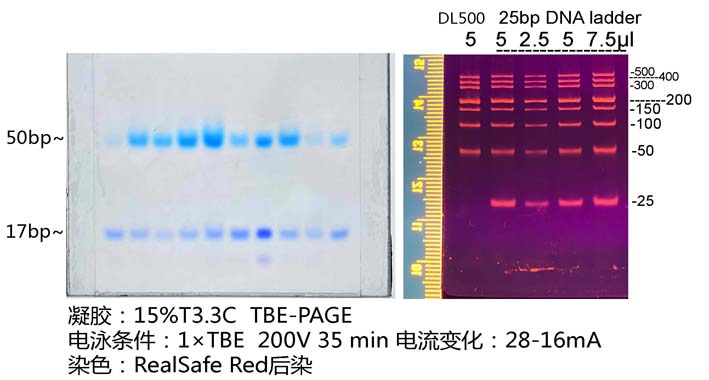
一、 TBE-PAGE凝膠分離:
1.1制備凝膠步驟:
1.1.1參照凝膠模具說明書,裝配好凝膠模具����。
1.1.2按照表一將不同體積的成分在小燒杯或試管中混合;最后加入10%APS和TEMED�,輕輕攪拌使其混勻,避免產(chǎn)生氣泡�����。
注:25bp DNA ladder適用于配制15%TBE-PAGE膠��。
1.1.3在凝膠模具中灌入適量分離膠溶液(對于mini-gel��,凝膠液加至約距前玻璃板頂端1.5 cm或距梳齒約0.5 cm即可)�,然后在分離膠溶液上輕輕覆蓋一層1-2 cm的無水乙醇���,使凝膠表面保持平整����。
1.1.4靜置10-20分鐘���,待分離膠和乙醇層之間出現(xiàn)一個清晰的界面后���,說明凝膠已聚合
表一 TBE-PAGE分離膠配方表 (總體積5 ml�����,適用于1mm厚度小板膠)
|
|
|
各組份體積(ml)
|
|
最佳DNA分離范圍
|
凝膠濃度
|
滅菌水
|
30%PAA(29:1)
|
5×TBE
|
10%APS
|
TEMED
|
|
70-450 bp
|
6%
|
3
|
1.0
|
1.0
|
0.05
|
0.005
|
|
60-460 bp
|
8%
|
2.66
|
1.34
|
1.0
|
0.05
|
0.005
|
|
50-300 bp
|
10%
|
2.33
|
1.67
|
1.0
|
0.05
|
0.005
|
|
40-200 bp
|
12%
|
2
|
2.0
|
1.0
|
0.05
|
0.005
|
|
25-150 bp
|
15%
|
0.5
|
2.5
|
1.0
|
0.05
|
0.005
|
|
5-100 bp
|
20%
|
0.66
|
3.34
|
1.0
|
0.05
|
0.005
|
1.1.5去除覆蓋在分離膠上的乙醇�;按照表二將不同體積成分在一個小燒杯或試管中混合����;最后加入10%過硫酸銨和TEMED,輕輕攪拌使其混勻���,避免產(chǎn)生氣泡��。
表二 TBE-PAGE 4%濃縮配方表 (總體積1.5 ml���,適用于1mm厚度小板膠)
|
|
各組份體積(ml)
|
|
凝膠濃度
|
滅菌水
|
30%PAA(29:1)
|
5×TBE
|
10%APS
|
TEMED
|
|
4%
|
1.0
|
0.2
|
0.3
|
0.02
|
0.002
|
1.1.6將濃縮膠溶液加至分離膠的上面,直至凝膠溶液到達前玻璃板的頂端�;將梳子插入凝膠內,避免產(chǎn)生氣泡�。
1.1.7靜置30-60分鐘,等待濃縮膠聚合�����。
注:凝膠的聚合時間與環(huán)境溫度有關。夏天溫度較高時����,聚合較快;冬天氣溫低時��,聚合時間會延長�����?����?梢愿鶕?jù)環(huán)境溫度的不同調節(jié)APS的加入量���。
1.2 電泳:
1.2.1 將凝膠板固定在電泳裝置上,往上槽和下槽中加入1×TBE電泳液�,1 ml吸頭沖洗加樣孔1-2次。
1.2.2 取待測樣品�,加入相應體積6×Native PAGE DNA上樣緩沖液,如5 μl樣品加1 μl 上樣緩沖液�,短暫離心后取5-10 μl上樣。 25bp DNA
ladder已經(jīng)含有上樣緩沖液���,1
mm厚10齒梳子直接上樣5
μl�����,其余梳齒和厚度凝膠適量調整上樣量�����。
1.2.3 連接電源線����,打開電源開關。200 V穩(wěn)壓電泳�����。至二甲苯菁指示前沿到達距離凝膠下沿二分之一位置時結束電泳(~50bp)��,此時溴酚藍指示前沿在凝膠下沿邊界(~17bp)�����。
|
PAGE凝膠濃度
|
恒電壓
|
起始電流
|
結束電流
|
二甲苯菁
|
溴酚藍
|
電泳時間
|
|
15%
|
200 V
|
25-30
mA/板膠
|
10-18 mA/板膠
|
~50 bp
|
~17 bp
|
35+min
|
1.3染色:
1.3.1 漂洗:玻璃板上拆下凝膠后��,適量蒸餾水漂洗3-5分鐘��。
1.3.2 染色液配制:
TBE-PAGE膠可以使用RealSafe類染料后染染色,以下程序用RealSafe Red核酸染料(貨號:GR002)進行染色���。即用型染色液配制:
|
|
即用型RealSafe核酸染色液
|
|
|
配制量100 ml
|
|
1×TBE
|
100 ml
|
|
RealSafe Red核酸染料
|
10 μl
|
1.3.3染色和觀察:
凝膠浸泡于即用型染色液中���,常溫避光搖床40-60 rpm染色30 分鐘。紫外光或藍光儀下觀察���。
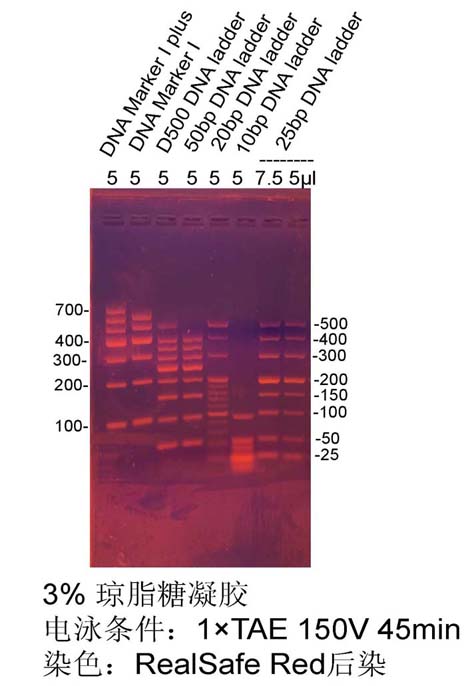
二���、 瓊脂糖凝膠分離:
2.1 瓊脂糖凝膠制備:
由于片段較小,建議選用高分辨率瓊脂糖(貨號AR1036)制膠�����。以下步驟以制備50
ml 3%凝膠為例:
稱取1.5
g瓊脂糖于玻璃三角瓶中��,加入50
ml 1×TAE����,5 μl RealSafe Red核酸染料或其他核酸染料(如EB��,GoldView)�,混勻�,蓋好瓶蓋����,微波爐中火加熱至沸騰,輕搖混勻�����,重復1-2次至瓊脂糖完全溶解��,無可見顆粒���。倒入制膠容器中��,插好梳子�����,常溫凝固30-50分鐘至凝膠完全凝固�。
2.2 電泳:
取待測樣品���,加入相應體積6×DualColor DNA loading buffer�,如10 μl樣品加2 μl 上樣緩沖液��,短暫離心后取5-10 μl上樣。 25bp DNA
ladder 1 mm厚10齒梳子上樣5 μl����,其余梳齒和厚度凝膠適量調整上樣量。
建議電泳條件:凝膠濃度為3%���,電泳電壓8-10
v/cm(單位電壓指電泳槽陰陽極之間的距離電壓�����,如陰極陽極之間的距離為20 cm����,可以用160-200
V電壓進行穩(wěn)壓電泳)�����,待溴酚藍指示前沿距離凝膠末端2 cm時終止電泳����,電泳時間35-40分鐘����。
|
瓊脂糖濃度
|
電泳緩沖液
|
二甲苯菁
|
溴酚藍
|
單位電壓
|
電泳時間
|
|
3%
|
1×TAE
|
~1000 bp
|
~100 bp
|
8-10 V/cm
|
40min+
|
|
1×TBE
|
~700 bp
|
~60 bp
|
8-10 V/cm
|
40min+
|
2.3觀察條帶���。
注:使用EB或Goldview染料時,由于染料本身帶正電荷較多����,隨著電泳時間的延長,染料會向陰極聚集����,導致小片段核酸結合的染料含量降低,會出現(xiàn)小片段的DNA片段紫外燈下亮度變弱或不可見����。此時可以將膠浸泡于含有染料的電泳緩沖液中染色15-20分鐘即可看到小片段。使用RealSafe類染料可以直接觀察條帶�。
2.4 實驗示例: